HESA Rapport du Comité
Si vous avez des questions ou commentaires concernant l'accessibilité à cette publication, veuillez communiquer avec nous à accessible@parl.gc.ca.
Conseil d’examen du prix des médicaments brevetés : Assurer l’efficacité du processus de réforme
Introduction
Le Conseil d’examen du prix des médicaments brevetés (le CEPMB, ou Conseil) est un organisme indépendant et quasi judiciaire chargé d’assurer que le prix des médicaments brevetés au Canada n’est pas excessif pendant la période d’exclusivité de marché accordée aux titulaires de brevets. Depuis 2016, le Conseil s’est affairé à réformer sa façon d’évaluer le prix des médicaments. La démission de la présidente par intérim, d’un membre et du directeur exécutif du CEPMB entre décembre 2022 et février 2023 a soulevé des questions concernant le fonctionnement du Conseil et ses efforts continus pour réaliser les réformes en matière des prix des médicaments. Ces démissions sont survenues après la publication des Lignes directrices proposées pour mettre en œuvre les changements réglementaires entrés en vigueur en juillet 2022. L’application active de ces modifications réglementaires dépend de la formulation de la version définitive des Lignes directrices. Deux des personnes concernées ont rendu publiques les diverses raisons qui les ont poussées à démissionner. Certaines de ces raisons semblaient soulever des doutes quant à l’intégrité du processus de réforme des Lignes directrices.
Pour mieux comprendre les événements qui ont conduit à ces trois démissions, le Comité permanent de la santé de la Chambre des communes (le Comité) a adopté la motion suivante le 9 mars 2023 :
Que, conformément à l’article 108(2) du Règlement, le Comité entreprenne une étude du Conseil d’examen du prix des médicaments brevetés (CEPMB); que le Comité invite les témoins suivants à comparaître, en plus de tout autre témoin qu’il jugera pertinent d’inviter :
- l’honorable Jean-Yves Duclos, ministre de la Santé;
- Matthew Herder, ancien membre du CEPMB;
- Mélanie Bourassa Forcier, ancienne présidente intérimaire du CEPMB;
- Douglas Clark, ancien directeur exécutif du CEPMB;
que le Comité fasse rapport de ses observations et de ses recommandations à la Chambre; et que, conformément à l’article 109 du Règlement, le Comité demande au gouvernement de déposer une réponse globale au rapport[1].
Le Comité a tenu deux réunions sur cette question (27 avril et 2 mai 2023), au cours desquelles il a entendu sept témoins : les quatre témoins nommés dans la motion et trois fonctionnaires représentant le ministère de la Santé et le ministère de la Justice. Il a également reçu sept mémoires. En outre, les quatre témoins mentionnés dans la motion du 9 mars 2023 ont chacun envoyé les correspondances demandées par le Comité dans la motion du 4 mai 2023[2].
Le présent rapport fournit des renseignements généraux sur les réformes du CEPMB et résume les témoignages recueillis au cours de l’étude. Il contient également des recommandations à l’intention du gouvernement fédéral afin d’améliorer l’efficacité des activités du CEPMB et, en particulier, de veiller à la mise en œuvre réussie des réformes réglementaires.
Réformes du CEPMB
Le CEPMB est un organisme quasi judiciaire qui exécute son mandat en toute indépendance du ministre fédéral de la Santé. Il a été créé en 1987 en vertu de la Loi sur les brevets[3]. Son mandat est double : veiller à ce que le prix des médicaments brevetés ne soit pas excessif pendant la période d’exclusivité de marché accordée aux titulaires de brevets et fournir des renseignements sur les tendances des prix des médicaments dans l’industrie pharmaceutique[4]. Le CEPMB examine le prix départ usine des médicaments brevetés. L’article 85 de la Loi sur les brevets énonce les facteurs que le Conseil doit prendre en considération pour déterminer si le prix d’un médicament breveté est excessif, tels que le prix de vente du médicament à l’étranger et le prix de vente d’autres médicaments de la même catégorie thérapeutique[5].
Si le prix d’un médicament semble excessif, le CEPMB lance une enquête qui peut déboucher sur un engagement de conformité volontaire de la part du breveté ou une audience publique. Si, à l’issue d’une audience, le Conseil estime que le prix du médicament est excessif, il peut ordonner au breveté de le réduire et de rembourser la partie excessive des recettes qu’il a tirées de la vente de son produit à un prix excessif[6].
Dans un rapport publié en 2015, le Groupe consultatif sur l’innovation des soins de santé de Santé Canada se dit préoccupé par la capacité du CEPMB à réduire le prix excessif des médicaments. Il y recommande que le gouvernement fédéral « examine et renforce le CEPMB, en accordant une attention particulière au choix des pays de référence et à la façon dont le CEPMB parvient à un prix de référence[7] ».
Même le CEPMB, dans son Plan stratégique 2015–2018, mentionne que « [p]ris ensemble, les prix relativement élevés des médicaments brevetés et le creux record de la R-D [recherche et développement] remettent en cause l’efficacité du régime actuel dans l’atteinte de ses objectifs politiques initiaux[8] ».
Par la suite, le CEPMB a entrepris de réformer ses Lignes directrices en publiant, en 2016, un document intitulé Modernisation des Lignes directrices du CEPMB : document de discussion[9]. Les Lignes directrices, qui sont autorisées en vertu du paragraphe 96(4) de la Loi sur les brevets, visent à informer les titulaires de brevets au sujet du processus suivi par le CEPMB pour déterminer si le prix d’un médicament breveté semble excessif[10]. En 2017, le gouvernement du Canada a proposé des modifications au cadre réglementaire du CEPMB[11].
Modifications au Règlement sur les médicaments brevetés
Le Règlement sur les médicaments brevetés[12] (le Règlement) est pris en application de la Loi sur les brevets. L’avis de projet de modification du Règlement a été publié dans la Gazette du Canada le 2 décembre 2017[13]. Le 21 août 2019, après avoir consulté les intervenants, le gouvernement fédéral a publié les modifications au Règlement[14].
La mise à jour de la liste des pays de comparaison était l’un des principaux changements apportés par les modifications. Cette liste, appelée « CEPMB11 », comprend l’Allemagne, l’Australie, la Belgique, l’Espagne, la France, l’Italie, le Japon, la Norvège, les Pays-Bas, le Royaume-Uni et la Suède. Contrairement à la liste précédente des pays de comparaison (« CEPMB7 »), la liste révisée exclut les États-Unis et la Suisse, soit les pays où le prix des médicaments est le plus élevé dans le monde.
L’entrée en vigueur du Règlement modifié était initialement prévue pour le 1er juillet 2020, mais elle a été reportée à quatre reprises, de six mois chaque fois. Selon le gouvernement du Canada, la pandémie de COVID‑19 explique en partie ces délais[15]. En août 2019, Merck Canada Inc. et six autres sociétés pharmaceutiques ont déposé une demande de révision judiciaire auprès de la Cour supérieure du Québec; ils y contestaient la validité du régime spécial pour les médicaments protégés ou brevetés prévu par la Loi sur les brevets, le Règlement et les modifications de 2019[16]. En février 2022, la Cour d’appel du Québec a rendu une décision confirmant la constitutionnalité du régime existant et de la liste révisée des pays de comparaison, tout en déclarant invalides d’autres modifications réglementaires[17]. Le procureur général du Canada n’a pas demandé l’autorisation d’interjeter appel de cette décision devant la Cour suprême du Canada[18].
En avril 2022, le ministre de la Santé (le Ministre) a annoncé que le gouvernement fédéral mettrait en œuvre la liste révisée des pays de comparaison et la réduction des exigences de déclaration pour les médicaments à faible risque de prix excessif, mais qu’il abrogerait les modifications jugées invalides dans l’arrêt Merck[19]. Le Règlement modifié est entré en vigueur le 1er juillet 2022[20]. Le CEPMB n’appliquera cependant pas ces modifications tant qu’il n'aura pas formulé la version définitive de ses Lignes directrices[21].
Lignes directrices provisoires de 2022 du CEPMB
En vertu de l’article 96 de la Loi sur les brevets, le CEPMB est autorisé à publier des directives non contraignantes après avoir consulté le ministre fédéral de la Santé, les ministres provinciaux de la Santé et « les représentants des groupes de consommateurs et de l’industrie pharmaceutique que le ministre [fédéral de la Santé] peut désigner à cette fin[22] ».
Le 6 octobre 2022, le CEPMB a publié un projet de nouvelles Lignes directrices qui visaient à donner effet au Règlement modifié, entré en vigueur le 1er juillet 2022[23]. Il a également ouvert une période de consultation de 60 jours[24]. À ce moment, le CEPMB pensait que les Lignes directrices entreraient en vigueur le 1er janvier 2023. Il a organisé des webinaires sur le sujet et a reçu 88 mémoires au cours de la période de consultation, qui s’est terminée le 5 décembre 2022. Au moment de la rédaction du présent rapport, les nouvelles Lignes directrices n’avaient pas encore été mises en œuvre.
Lettres à la présidente par intérim
Le 18 novembre 2022, la présidente de Médicaments novateurs Canada (MNC), un groupe d’intervenants de l’industrie, a envoyé une lettre à la présidente par intérim du CEPMB pour lui faire part de ses préoccupations concernant les Lignes directrices proposées et demander à la rencontrer[25].
Le 28 novembre 2022, le Ministre a écrit à la présidente par intérim. Dans sa lettre, il indique ce qui suit :
[C]ette nouvelle version des lignes directrices marque un changement fondamental par rapport à la pratique de longue date qui consiste à inclure des tests appliqués aux prix et des plafonds de prix. La nouvelle version inclut plutôt des critères d’enquête.
Compte tenu de la nouvelle orientation définie dans les nouvelles lignes directrices proposées, il est essentiel que tous les intervenants comprennent parfaitement comment les nouvelles lignes directrices seront mises en œuvre. De nombreux intervenants ont soulevé des préoccupations et des questions relatives aux nouvelles lignes directrices, et cherchent à obtenir davantage d’informations sur les répercussions potentielles et sur l’opérationnalisation de certains aspects techniques clés des lignes directrices. Ce n’est qu’avec cette compréhension plus détaillée que les intervenants peuvent s’impliquer de manière importante dans le processus de consultation. Parallèlement, le Conseil bénéficiera de l’avis et de la rétroaction des intervenants dans le cadre de son processus décisionnel[26].
Le Ministre a demandé au Conseil « d’envisager de suspendre le processus de consultation [pour] laisser le temps de travailler en collaboration, avec tous les intervenants, en vue de comprendre pleinement les répercussions à court et à long terme des nouvelles lignes directrices proposées[27] ».
Démissions au CEPMB
Le 5 décembre 2022, Mélanie Bourassa Forcier a démissionné de son poste de présidente par intérim du CEPMB. Elle s’est à ce moment refusée à tout commentaire, invoquant des contraintes juridiques[28], mais le 3 mars 2023, elle a publié une lettre expliquant les raisons de son départ[29]. Elle y fait part des inquiétudes qu’elle a ressenties face aux lettres du Ministre et de MNC et à ce qu’elle considérait comme un processus de consultation insuffisant auprès des intervenants au sujet des Lignes directrices proposées. Elle a démissionné le dernier jour du processus de consultation, ne souscrivant pas à la position des autres membres du Conseil et du directeur exécutif sur le déroulement du processus. Dans sa lettre, elle exprime l’avis que le CEPMB ne respectait pas ses obligations et que la décision de ne pas prolonger la période de consultation créait un risque de litige et mettait potentiellement en péril l’accessibilité des médicaments au Canada.
Le 20 février 2023, Matthew Herder a démissionné de son poste de membre du Conseil et a expliqué sa décision dans une lettre publique[30], dans laquelle il soutient que le gouvernement a échoué à plusieurs reprises à mettre en œuvre les réformes du CEPMB. Il expose les trois principales raisons de sa démission : de son point de vue, le gouvernement n’a pas réussi à défendre les changements de politique devant les tribunaux, il a repoussé la date d’entrée en vigueur du nouveau Règlement et il a miné l’indépendance et la crédibilité du CEPMB. Selon lui, le Ministre est intervenu dans le processus indépendant du CEPMB en demandant que le processus de consultation sur les Lignes directrices soit suspendu.
Le 24 février 2023, le CEPMB a annoncé que Douglas Clark quittait ses fonctions de directeur exécutif[31]. Aucune raison n’a alors été rendue publique pour sa démission.
La figure 1 montre l’organigramme du CEPMB avant les démissions. Le Ministre a nommé un nouveau président, Thomas J. Digby, le 1er février 2023[32].
La figure 2 présente une chronologie des événements clés du processus de réformes du CEPMB.
Figure 1 — Organigramme du CEPMB, 2021
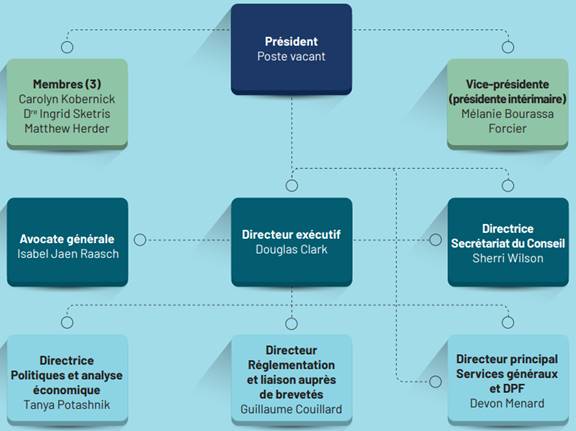
Source : CEPMB, Rapport annuel 2021.
Figure 2 — Chronologie des réformes du CEPMB (événements clés)

Source : Figure produite par la Bibliothèque du Parlement.
Discussion des événements qui ont précédé les démissions
Les témoignages recueillis dans le cadre de cette étude ont porté sur les événements survenus au cours de la période de consultation menée à l’automne 2022 sur le projet de Lignes directrices du CEPMB et sur les démissions subséquentes de la présidente par intérim, d’un membre et du directeur exécutif du Conseil. Parmi les thèmes qui sont ressortis des témoignages, citons des allégations d’ingérence de la part du Ministre dans le processus de consultation sur les Lignes directrices du CEPMB; l’influence de l’industrie pharmaceutique sur la politique canadienne en matière de médicaments et des problèmes liés au mode de fonctionnement du CEPMB.
Allégations d’ingérence de la part du ministre de la Santé
Dans sa lettre de démission, adressée au ministre de la Santé Jean-Yves Duclos, Matthew Herder affirme que la demande du Ministre de suspendre le processus de consultation sur les Lignes directrices « a miné la crédibilité du Conseil et entravé l’exercice d’une fonction qui est au cœur même de son expertise en tant que tribunal administratif indépendant et autonome[33] ». De façon plus générale, il a déclaré au Comité que les interactions entre le CEPMB et Santé Canada au cours du processus de consultation de 2022 sur les Lignes directrices représentaient un « changement radical » par rapport aux habitudes de communication qui prévalaient pendant son mandat[34]. L’absence de réunions entre le Ministre et le Conseil, ainsi que l’intention et l’incidence de la lettre du Ministre à la présidente par intérim, ont été deux points centraux de la discussion dans le cadre du témoignage.
Absence de réunions entre le CEPMB et le ministre de la Santé
Le Comité a appris que le CEPMB et les fonctionnaires de Santé Canada tiennent régulièrement des réunions de travail[35].
En ce qui concerne les interactions entre le Ministre et le CEPMB, les témoins ont fait référence à deux dispositions de la Loi sur les brevets. L’article 102 porte sur les réunions entre le Ministre et le Conseil et se lit comme suit :
- 1) Le ministre peut, à sa discrétion, convoquer une réunion des
personnes suivantes :
- a) le président et les conseillers que celui-ci désigne;
- b) les ministres provinciaux responsables de la santé ou leurs représentants;
- c) les représentants des groupes de consommateurs et de l’industrie pharmaceutique que le ministre peut désigner;
- d) les autres personnes que le ministre estime indiquées[36].
Par ailleurs, en vertu de l’article 96 de la Loi sur les brevets, le ministre est l’une des parties que le CEPMB doit consulter avant de publier des directives :
- (4) Sous réserve du paragraphe (5), le Conseil peut formuler des directives — sans que lui, les titulaires de droits ou les anciens titulaires de droits ne soient liés par celles‑ci — sur toutes questions relevant de sa compétence.
- Consultation
- (5) Avant de formuler des directives, le Conseil doit consulter le ministre, les ministres provinciaux responsables de la santé et les représentants des groupes de consommateurs et de l’industrie pharmaceutique que le ministre peut désigner à cette fin[37].
Il y avait un manque de clarté parmi les témoins quant à la personne qui devait ou pouvait prendre contact avec l’autre. Le Ministre a affirmé ce qui suit : « [I]l aurait été inapproprié pour moi de vouloir entrer en contact avec la présidence, si cette dernière n’avait pas entrepris cette démarche[38]. » De son côté, Mélanie Bourassa Forcier a déclaré ceci : « On me disait que, pour pouvoir rencontrer le ministre, je devais attendre qu’il m’invite. Je ne l’ai donc pas rencontré parce que je n’ai pas reçu d’invitation en ce sens[39]. » Elle a d’ailleurs indiqué qu’elle ne l’avait jamais rencontré au cours de son mandat de présidente par intérim, entre novembre 2021 et décembre 2022, bien qu’elle ait demandé à plusieurs reprises au personnel du CEPMB d’organiser une telle réunion, y compris à son arrivée[40]. Le Ministre n’a pas abordé le sens du paragraphe 102(1) de la Loi sur les brevets.
Douglas Clark, qui a été directeur exécutif du CEPMB pendant dix ans, a affirmé que pendant son mandat, c’est habituellement le bureau du sous-ministre qui demandait la tenue d’une réunion et organisait cette dernière, « souvent à la demande du bureau du ministre[41] ». Il a expliqué qu’à titre de directeur exécutif, il était parfois appelé à assumer certaines tâches pour le compte de la présidence. Il a ajouté qu’« à l’exception de l’actuel ministre, [il a] personnellement informé tous les ministres de la Santé de la réforme des lignes directrices, depuis la ministre Ambrose, sous le gouvernement précédent, soit au nom du président soit avec lui[42] ».
Mélanie Bourassa Forcier a déclaré que seule la présidente peut entrer en contact avec le ministre fédéral de la Santé, conformément aux Lignes directrices de la présidente relatives à la conduite des membres du Conseil (Lignes directrices de la présidente), et que l’organigramme du CEPMB n’établit aucun lien entre le directeur exécutif et ce ministre[43]. Selon l’article 35 des Lignes directrices de la présidente, « [l]es membres du Conseil autres que la présidente devraient s’efforcer de réduire au minimum les communications avec les députés, les ministres, les politiciens et les fonctionnaires de l’extérieur du personnel du Conseil sur toute question relative au CEPMB[44] ».
Douglas Clark a fait part au Comité de ses tentatives infructueuses d’organiser une rencontre avec le Ministre. Il a affirmé avoir « personnellement tenté à de nombreuses reprises d’entrer en contact avec le chef de cabinet du ministre ainsi que son conseiller de politique principal, au moyen de textes, de courriels et d’appels téléphoniques[45] », mais les fonctionnaires ne lui ont jamais répondu. Des documents attestant de ces communications, qui ont eu lieu entre le 9 novembre 2022 et le 21 novembre 2022, ont été inclus dans le dossier présenté par Douglas Clark au Comité[46].
Mélanie Bourassa Forcier a également raconté au Comité qu’elle avait tenté en vain d’organiser une rencontre avec le Ministre et que le personnel du CEPMB s’y était opposé pour non‑respect de « la chaîne hiérarchique[47] ». Elle a décrit ses nombreuses demandes pour rencontrer le Ministre après avoir « constaté qu’il y avait une difficulté de communication entre Santé Canada et le CEPMB[48] ». Dans le dossier qu’elle a présenté au Comité, elle dit ne pas avoir été informée des tentatives de Douglas Clark de prendre contact avec le Ministre[49]. Douglas Clark a nié qu’il a dissimulé de l’information à la présidente par intérim ou que le personnel du CEPMB a fait obstacle à ses demandes d’organiser une rencontre entre le Ministre et elle[50].
Les correspondances que Mélanie Bourassa Forcier a présentées au Comité démontrent qu’elle a demandé à Douglas Clark, le 18 novembre 2022, d’organiser une rencontre avec le Ministre[51]. Elle a fait une demande similaire à la secrétaire exécutive du Conseil le 21 novembre 2022[52]. Elle a également demandé à rencontrer le Ministre dans sa réponse du 30 novembre 2022 à la lettre de celui-ci[53].
Le 30 novembre 2022, Mélanie Bourassa Forcier et Douglas Clark ont rencontré le sous‑ministre Steven Lucas.
Réactions à la lettre du ministre de la Santé
La lettre du Ministre demandant au Conseil d’envisager une suspension (ou une pause) du processus de consultation sur les Lignes directrices a surpris les témoins qui travaillaient pour le CEPMB à l’époque[54]. Leurs avis divergent cependant quant à la bienséance et à l’intention de la lettre.
L’honorable Jean-Yves Duclos a déclaré que la lettre avait été envoyée dans le cadre des consultations sur le projet de Lignes directrices, conformément au paragraphe 96(5) de la Loi sur les brevets, qui stipule que le CEPMB doit consulter le Ministre, entre autres parties, avant que le Conseil ne publie des lignes directrices[55].
Douglas Clark a déclaré au Comité que le contenu de la lettre l’avait « beaucoup inquiété », tout comme il avait inquiété les cadres supérieurs et l’avocate générale du CEPMB[56]. Il a ajouté que la demande l’avait surpris, car le personnel de Santé Canada avait semblé soutenir l’approche stratégique. Il a précisé que le personnel du CEPMB avait communiqué avec le personnel de Santé Canada à sept reprises entre le 4 octobre 2022 et le 25 novembre 2022 et que Santé Canada n’avait alors exprimé aucune préoccupation au sujet du projet de Lignes directrices[57]. En outre, M. Clark a déclaré au Comité qu’il avait, en compagnie d’autres hauts fonctionnaires du CEPMB, rencontré MNC et environ 20 représentants de l’industrie pour discuter du projet de Lignes directrices le 23 novembre 2022[58].
Mélanie Bourassa Forcier a répondu à la demande du Ministre dans une lettre datée du 30 novembre 2022 dans laquelle elle exprime sa surprise devant les préoccupations soulevées, alors qu’elle pensait auparavant que les fonctionnaires de Santé Canada étaient « confortables et d’accord avec l’approche présentée ». Elle a aussi souligné les efforts de consultation qui ont déjà été faits :
[D]ès le début le CEPMB a fait part de ces consultations à [Santé Canada] ainsi qu’à tous les ministères provinciaux de la Santé, et a tenu des entretiens de suivi avec les représentants des ministères provinciaux de la Santé ainsi qu’avec l’Alliance pharmaceutique pancanadienne (APC). Nous avons également organisé des webinaires pour l’industrie pharmaceutique, tenu de longues réunions avec [Médicaments novateurs Canada (MNC)] et avec plusieurs sociétés membres de [MNC][59].
Dans sa lettre de démission, Matthew Herder a affirmé que la demande du Ministre avait miné l’indépendance et la crédibilité du CEPMB[60]. Il a dit au Comité qu’il a perçu la demande comme « une suggestion très forte, voire une exigence[61] ». Il estime que la lettre reprend en partie les arguments de l’industrie et a fait remarquer que le CEPMB a reçu une demande similaire de la part d’un groupe de l’industrie pharmaceutique. La lettre, a-t-il dit, a eu un « effet extrêmement clivant sur le CEPMB[62] ».
Il y avait un désaccord fondamental entre les membres du Conseil sur la façon dont le CEPMB devait répondre à la demande du Ministre. Mélanie Bourassa Forcier a fait valoir que certains membres du CEPMB avaient peut-être interprété la notion de « suspension » de manière trop restrictive, comme si elle signifiait « cesser » ou « arrêter » et non « prolonger » le processus de consultation[63]. Elle a expliqué qu’elle a voulu mieux comprendre les possibles répercussions des Lignes directrices sur les intervenants et traiter de toute question juridique éventuelle[64]. De plus, Mme Bourassa Forcier a souligné l’importance de prévoir suffisamment de temps pour consulter les intervenants conformément au paragraphe 96(5) de la Loi sur les brevets, particulièrement en raison des préoccupations exprimées par l’industrie et les groupes de patients à l’égard du projet de Lignes directrices. Elle a proposé deux options aux membres du Conseil : une réunion avec MNC avant la fin de la période de consultation, ou la suspension ou la prolongation de la période de consultation en attendant une telle réunion[65].
Les autres membres du Conseil souhaitaient que le processus de consultation suive son cours et se termine comme prévu le 5 décembre 2022, après quoi le Conseil déciderait, à sa réunion trimestrielle du 13 décembre 2022, de la suite à donner aux Lignes directrices et de la nécessité de prévoir une autre période de consultation[66]. Ils ont estimé qu’ils pouvaient attendre jusqu’après la réunion trimestrielle du Conseil pour communiquer avec le Sous‑Ministre au sujet du processus d’élaboration des Lignes directrices. Ils se sont également montrés ouverts à l’idée de rencontrer régulièrement MNC, comme l’avait proposé la présidente de MNC dans sa lettre du 18 novembre 2022 à la présidente par intérim du CEPMB[67].
Selon Mélanie Bourassa Forcier, il n’y a pas eu d’ingérence de la part du Ministre[68] et elle n’a pas remis sa démission le 5 décembre 2022 en raison de la lettre que ce dernier a écrite. Parlant des raisons de sa démission, elle a souligné son malaise devant la décision du Conseil « de rester muets face à la demande du ministre et de proposer à MNC une rencontre au courant de l’année 2023[69] ». En outre, tenir une réunion avec les intervenants après la période de consultation lui apparaissait « directement en contravention avec les principes de justice fondamentale et d’équité procédurale[70] ».
Influence de l’industrie pharmaceutique sur la politique relative aux médicaments
L’opposition de l’industrie pharmaceutique au projet de Lignes directrices de 2022, ainsi qu’aux précédentes consultations sur les Lignes directrices, a été un autre thème abordé par les témoins. Plusieurs d’entre eux ont souligné la résistance de l’industrie à aborder les changements proposés[71]. Dans une note d’information envoyée au Ministre le 8 décembre 2021, Mélanie Bourassa Forcier écrit qu’« après cinq ans d’innombrables propositions de politiques et plusieurs centaines d’heures de consultation, il semble que l’industrie pharmaceutique n’est simplement pas en faveur de quelconque mesure qui limiterait davantage sa capacité à vendre des médicaments brevetés au Canada à des prix du libre marché[72] ».
Au cours de son témoignage, Matthew Herder a souligné le pouvoir d’influence de l’industrie sur la politique pharmaceutique au Canada. Le Comité s’est fait dire que l’industrie pharmaceutique dispose de beaucoup plus de ressources que le CEPMB et qu’il est donc difficile pour ce dernier de mettre en œuvre des réformes qui auraient pour effet de réduire les revenus de l’industrie. Comme l’a expliqué Douglas Clark : « Le Conseil d’examen du prix des médicaments brevetés, c’est David contre le Goliath qu’est cette industrie transnationale à un billion de dollars[73]. »
Selon Matthew Herder, l’influence de l’industrie semble s’étendre à Santé Canada. Il a laissé entendre que cette influence avait incité le Ministre à demander la suspension des consultations du CEPMB : « L’industrie sait maintenant qu’elle peut contourner le CEPMB lorsqu’elle est insatisfaite de l’orientation stratégique du Conseil et amener le ministre à faire ses quatre volontés[74]. » Il a ajouté que « Santé Canada semble communiquer directement avec l’industrie[75] ». Certains témoins ont mentionné le nombre de réunions qui ont eu lieu entre les lobbyistes de l’industrie pharmaceutique et le Ministère au cours du processus de consultation sur les Lignes directrices. On trouve dans les correspondances soumises par Douglas Clark et Matthew Herder de l’information provenant du registre des lobbyistes qui montre que le Ministère a rencontré des groupes d’intérêt et des sociétés pharmaceutiques à 13 reprises au moins entre octobre et décembre 2022[76]. Interrogé sur le nombre de fois où il a rencontré des lobbyistes, l’honorable Jean-Yves Duclos a répondu ceci au Comité : « J’ai rencontré ces intervenants de l’industrie — y compris des exportateurs, des fabricants et des concepteurs — pour toutes sortes de raisons, notamment pour remédier aux pénuries d’analgésiques que nous avons connues[77]. »
Certains témoins ont laissé entendre que les réformes des Lignes directrices du CEPMB pourraient menacer les investissements dans la capacité de production de médicaments ou l’approvisionnement en médicaments en cas de pandémie. Selon Douglas Clark, une telle crainte peut vouloir dire que « le besoin d’améliorer nos relations avec l’industrie l’a emporté sur l’évaluation du bien-fondé des lignes directrices[78] ». Lorsqu’on lui a demandé si elle craignait que les sociétés pharmaceutiques ne limitent l’accès aux vaccins en cas de pandémie si les réformes du CEPMB étaient mises en œuvre, Mélanie Bourassa Forcier a déclaré : « Oui, cela me préoccupait[79]. »
Le Comité a entendu des témoignages concernant l’influence de l’industrie pharmaceutique sur l’opinion publique au sujet des réformes du CEPMB; certains témoins ont d’ailleurs exprimé des préoccupations à l’égard des inexactitudes ou des fausses déclarations observées dans les messages de l’industrie. Selon Matthew Herder, il faudrait en faire plus pour lutter contre ces informations trompeuses : « L’industrie déforme les faits parce qu’elle le peut et parce que nous la laissons faire[80]. »
Les témoins ont également traité des possibles conflits d’intérêts entre les membres du Conseil et l’industrie pharmaceutique. De l’avis de Mélanie Bourassa Forcier, le fait que le président du CEPMB ait acquis une expertise dans l’industrie, comme c’est le cas du président actuel, est un atout et non un problème[81]. Pour Matthew Herder, le fait que des membres du Conseil assument des fonctions dans l’industrie à la fin de leur mandat pose problème[82]. Il a fait valoir qu’il faut se pencher sur les conflits d’intérêts entre le CEPMB et l’industrie : « À moins que nous commencions à prendre les conflits d’intérêts beaucoup plus au sérieux, une réforme significative des prix sera impossible[83]. »
Problèmes relatifs au mode de fonctionnement du CEPMB
Au cours de son témoignage, Mélanie Bourassa Forcier a fait état de possibles problèmes de fonctionnement au sein du CEPMB, qui pourraient avoir précipité la détérioration des communications entre les membres du Conseil et avec Santé Canada et d’autres intervenants. Dans le dossier qu’elle a présenté au Comité, elle affirme que l’« absence de règles de fonctionnement à l’interne », en particulier à l’égard de la compréhension du rôle du directeur exécutif, créait des problèmes[84]. À son avis, les pratiques internes ont évolué au fil du temps, jusqu’à s’écarter de celles énoncées dans la Loi sur les brevets, les Lignes directrices de la présidente et l’organigramme du CEPMB. Mme Bourassa Forcier a recommandé que les procédures du CEPMB soient revues ou précisées dans plusieurs domaines[85].
Les correspondances soumises révèlent que les procédures internes ne sont pas claires pour les membres du Conseil. Par exemple, lorsque sa position à propos de la marche à suivre en réponse à la lettre du Ministre divergeait de celle du directeur exécutif et des autres membres, Mélanie Bourassa Forcier a déterminé qu’elle prendrait seule la décision de suspendre le processus de consultation, se fondant sur son interprétation des pouvoirs qui lui étaient conférés par la Loi sur les brevets[86]. Un avis juridique a été demandé pour savoir si la présidente pouvait « décider de façon indépendante et unilatérale des questions de fond liées à la publication des Lignes directrices du Conseil et à la consultation à leur sujet[87] ». Selon l’avis, les pouvoirs de la présidente « se limitent aux fonctions de premier dirigeant, à savoir les questions internes de gestion administrative courante et [ils] ne remplacent pas les pouvoirs conférés au Conseil dans son ensemble[88] ». Un avis juridique a également été demandé sur plusieurs autres questions liées aux règles applicables et aux obligations de la présidente et des autres membres du Conseil, comme les « obligations de confidentialité relatives aux discussions du Conseil sur des lignes directrices proposées[89] ».
Mélanie Bourassa Forcier a témoigné de l’importance d’un dialogue constructif avec l’industrie et les autres intervenants. Elle s’est dite préoccupée par la question de l’impartialité au sein du Conseil. Elle a expliqué au Comité que les membres du Conseil devraient adopter une approche neutre dans le cadre de leur devoir de consultation des intervenants. Elle a fait valoir que les multiples retards dans la mise en œuvre des réformes ont créé une tension entre le directeur exécutif et le cabinet du Ministre, et que les revers au cours du processus de réforme contribuent depuis longtemps au « dialogue de sourds » qui s’est établi entre le CEPMB et les parties prenantes[90].
Mélanie Bourassa Forcier a fait remarquer que les membres du Conseil n’avaient pas été informés du contenu des soumissions des parties prenantes avant la clôture de la période de consultation et que certaines de ces soumissions contenaient des demandes de prolongation du délai[91]. Elle a donc recommandé que les membres aient « accès, en temps réel, au contenu des soumissions présentées dans le contexte des consultations[92] ». Dans un courriel adressé aux membres du Conseil, Douglas Clark a souligné que les consultations de 2022 avaient « suivi le même protocole que celui suivi dans les deux séries de consultations précédentes sur les nouvelles Lignes directrices proposées en 2020[93] ». Selon lui, toute décision de rouvrir le processus de consultation ou d’en lancer un nouveau ne devrait être prise qu’une fois que les consultations en cours auront pris fin comme prévu et que le Conseil aura pu évaluer l’ensemble des réactions reçues.
Les témoins ont discuté du CEPMB de façon plus générale : de sa fonction, de ses responsabilités, de ses modes de fonctionnement et de son mandat. Le Ministre a souligné le soutien et le respect du gouvernement du Canada à l’égard du rôle du Conseil dans la protection des consommateurs contre le prix excessif des médicaments[94]. Il a également souligné qu’il fallait trouver un équilibre entre l’accessibilité financière des médicaments, la recherche et le développement et la disponibilité des médicaments au Canada[95]. Mélanie Bourassa Forcier a souligné l’importance du rôle de l’industrie dans la recherche et le développement et dans la mise sur le marché de médicaments novateurs. Elle a estimé que le gouvernement fédéral pourrait en faire plus pour soutenir l’innovation et l’accessibilité des médicaments. Elle a également suggéré que le mandat du Conseil soit précisé : « [L]e CEPMB ne sert-il qu’à s’assurer que le prix des médicaments brevetés n’est pas excessif, ou est-ce un organisme qui assure un accès à des médicaments à un prix non excessif[96]? »
Enfin, les témoins ont souligné l’importance de préserver l’indépendance du CEPMB. L’honorable Jean-Yves Duclos a fait remarquer que si le ministre de la Santé est responsable des dispositions de la Loi sur les brevets concernant le prix des médicaments brevetés et du cadre réglementaire régissant les médicaments brevetés, le CEPMB a le pouvoir d’émettre des lignes directrices non contraignantes à la suite de consultations avec certains intervenants[97]. Mélanie Bourassa Forcier, dans sa lettre au Ministre, a souligné que l’émission de directives non contraignantes est une fonction « qui va au cœur de l’expertise et de l’autonomie du Conseil[98] ». Matthew Herder, quant à lui, a souligné que le Conseil doit « demeurer maître de [ses] propres lignes directrices. L’ingérence devrait à tout prix être proscrite. Il faut renouveler l’engagement pour l’indépendance du Conseil[99]. »
Conclusion et recommandations
Le Comité a entendu des témoignages divergents sur les événements qui ont précédé la démission de la présidente par intérim, d’un membre et du directeur exécutif du CEPMB en 2022, à l’époque de la période de consultation sur le projet de Lignes directrices. Les témoins étaient divisés sur les raisons de la détérioration du processus de consultation. Certains ont dénoncé des pressions exercées par le ministre de la Santé et l’industrie pharmaceutique sur le Conseil, tandis que d’autres ont réfuté l’existence d’une ingérence extérieure et pointé du doigt les problèmes au sein du CEPMB, notamment la résistance à un véritable engagement des intervenants ou les ambiguïtés quant au mode de fonctionnement du Conseil.
Sept ans après son lancement, le processus de réforme du CEPMB n’est toujours pas achevé; tant que les nouvelles Lignes directrices n’auront pas été formulées, les modifications réglementaires entrées en vigueur en juillet 2022 ne seront pas mises en œuvre. Pour permettre au CEPMB de s’acquitter plus efficacement de son mandat de protection des consommateurs canadiens contre le prix excessif des médicaments et faire en sorte que le Conseil réussisse à réformer son approche de l’évaluation du prix des médicaments, le Comité formule les recommandations suivantes :
Recommandation 1
Que le gouvernement du Canada mette en place un protocole de communication clair entre le ministre de la Santé et la présidence et les membres du Conseil d’examen du prix des médicaments brevetés.
Recommandation 2
Que le gouvernement du Canada se penche sur le processus au moyen duquel il procède à la réforme réglementaire du Conseil d’examen du prix des médicaments brevetés.
Recommandation 3
Que le gouvernement du Canada examine la manière dont il interagit avec l’industrie pharmaceutique en tant que secteur réglementé disposant d’un pouvoir monopolistique en matière de fixation du prix des médicaments brevetés.
Recommandation 4
Que le mandat du Conseil d’examen du prix des médicaments brevetés soit clarifié. Le Conseil devrait avoir pour mandat de s’assurer que le prix des médicaments brevetés n’est pas excessif, tout en veillant à ce que la fixation du prix n’ait pas pour effet de limiter l’accès des patients aux médicaments, notamment dans le cas des maladies rares.
Recommandation 5
Que le Conseil d’examen du prix des médicaments brevetés revoie ses règles de fonctionnement interne afin qu’elles soient claires et transparentes. Il faudrait, par ailleurs, offrir un soutien indépendant et externe aux membres nommés au sein de l’organisme afin de les aider lors d’incompréhensions ou de problèmes.
Recommandation 6
Que le Conseil d’examen du prix des médicaments brevetés prenne en compte des études de cas pour avoir une meilleure idée de la manière dont ses futures Lignes directrices s’appliqueraient concrètement et de leurs possibles conséquences sur les patients et sur l’écosystème des sciences de la vie.
Recommandation 7
Que le Conseil d’examen du prix des médicaments brevetés intègre un éventail plus large d’intervenants dans l’élaboration de ses politiques.
Recommandation 8
Que les membres du Conseil d’examen du prix des médicaments brevetés aient toujours accès en temps réel au contenu des soumissions présentées dans le contexte des consultations.
Recommandation 9
Qu’un registre soit créé pour suivre le taux de pénétration des médicaments au Canada et le comparer avec celui de pays comparables.
Recommandation 10
Que le gouvernement du Canada tienne un registre public des innovations résultant du financement public, seul ou en partenariat avec l’industrie, et s’assure que ce qu’il finance est accessible sur le marché canadien.
[1] Chambre des communes, Comité permanent de la santé [HESA], Procès-verbal, 9 mars 2023.
[2] HESA, Procès-verbal, 4 mai 2023.
[3] Loi sur les brevets, L.R.C. (1985), ch. P-4.
[4] Conseil d’examen du prix des médicaments brevetés [CEPMB], Mandat et compétence.
[5] Loi sur les brevets, L.R.C. (1985), ch. P-4, art. 85.
[6] Gouvernement du Canada, « Processus réglementaire », Conseil d’examen du prix des médicaments brevetés.
[7] Santé Canada, Libre cours à l’innovation : Soins de santé excellents pour le Canada : Rapport du Groupe consultatif sur l’innovation des soins de santé, juillet 2015.
[8] CEPMB, Plan stratégique 2015–2018.
[9] CEPMB, Modernisation des Lignes directrices du CEPMB : document de discussion, juin 2016.
[10] Gouvernement du Canada, Lignes directrices du CEPMB.
[11] Règlement modifiant le Règlement sur les médicaments brevetés, Gazette du Canada, Partie I, 2 décembre 2017.
[12] Règlement sur les médicaments brevetés, DORS/94-688.
[13] Règlement modifiant le Règlement sur les médicaments brevetés, Gazette du Canada, Partie I, 2 décembre 2017.
[14] Règlement modifiant le Règlement sur les médicaments brevetés (facteurs additionnels et exigences supplémentaires relatives à la fourniture de renseignements) : DORS/2019-298, 8 août 2019, Gazette du Canada, Partie II, 21 août 2019.
[15] Règlement no 5 modifiant le Règlement modifiant le Règlement sur les médicaments brevetés (facteurs additionnels et exigences supplémentaires relatives à la fourniture de renseignements) : DORS/2022-162, Gazette du Canada, Partie II, 6 juillet 2022.
[16] Merck Canada inc. c. Procureur général du Canada, 2020 QCCS 4541 (CanLII); et Règlement no 5 modifiant le Règlement modifiant le Règlement sur les médicaments brevetés (facteurs additionnels et exigences supplémentaires relatives à la fourniture de renseignements) : DORS/2022-162, Gazette du Canada, Partie II, 6 juillet 2022.
[17] Merck Canada inc. c. Procureur général du Canada, 2022 QCCA 240 (CanLII).
[18] Voir aussi Médicaments Novateurs Canada c. Canada (Procureur général), 2022 CAF 210, confirmant la validité de la liste révisée des pays de comparaison.
[19] Santé Canada, Déclaration du ministre de la Santé sur l’entrée en vigueur du Règlement modifiant le Règlement sur les médicaments brevetés, 14 avril 2022.
[20] Règlement no 5 modifiant le Règlement modifiant le Règlement sur les médicaments brevetés (facteurs additionnels et exigences supplémentaires relatives à la fourniture de renseignements) : DORS/2022-162, Gazette du Canada, Partie II, 6 juillet 2022.
[21] HESA, Témoignages, 2 mai 2023, 1135 (Douglas Clark, directeur exécutif, Conseil d’examen du prix des médicaments brevetés).
[22] Loi sur les brevets, L.R.C. (1985), ch. P-4, par. 96(4)–96(5).
[23] CEPMB, Document d’information : Consultation sur les Lignes directrices provisoires du CEPMB, 2022, p. 2.
[24] Gouvernement du Canada, « Mises à jour de 2022 proposées aux Lignes directrices », Mises à jour de 2022 proposées aux Lignes directrices.
[25] Médicaments novateurs Canada, Lettre à Dre Mélanie Bourassa Forcier, Présidente par intérim, Conseil d’examen du prix des médicaments brevetés (CEPMB), 18 novembre 2022.
[26] Gouvernement du Canada, Lettre à la Présidente intérimaire et administratrice générale du Conseil d’examen du prix des médicaments brevetés, 28 novembre 2022.
[27] Gouvernement du Canada, Lettre à la Présidente intérimaire et administratrice générale du Conseil d’examen du prix des médicaments brevetés, 28 novembre 2022. La lettre originale a été envoyée en français uniquement. Une traduction anglaise non officielle a été communiquée aux membres du Conseil le 29 novembre 2022, en même temps que l’original. Une traduction officielle a été publiée sur le site Web de Santé Canada le 13 mars 2023. Les deux traductions utilisent le terme « pausing ».
[28] Mélanie Bourassa Forcier, Message publié sur X, 7 décembre 2022, 13 h 38 [disponible en anglais seulement].
[29] Mélanie Bourassa Forcier, Les raisons de ma démission du Conseil d’examen du prix des médicaments brevetés, 3 mars 2023.
[30] Matthew Herder, Re: Letter of Resignation, 20 février 2023 [disponible en anglais seulement].
[31] CEPMB, Douglas Clark quitte ses fonctions de directeur exécutif du Conseil d’examen du prix des médicaments brevetés, 24 février 2023.
[32] Santé Canada, Le gouvernement du Canada annonce une nomination au Conseil d’examen du prix des médicaments brevetés, 1er février 2023.
[33] Matthew Herder, Re: Letter of Resignation, 20 février 2023 [disponible en anglais seulement].
[34] HESA, Témoignages, 2 mai 2023, 1200 (Matthew Herder, directeur, Institut du droit de la santé, Université Dalhousie, à titre personnel).
[35] HESA, Témoignages, 27 avril 2023, 1145 (Eric Bélair, sous-ministre adjoint délégué, Direction générale de la politique stratégique, ministère de la Santé); et HESA, Témoignages, 2 mai 2023, 1105 (Douglas Clark).
[36] Loi sur les brevets, L.R.C. (1985), ch. P-4, art. 102.
[37] Loi sur les brevets, L.R.C. (1985), ch. P-4, par. 96(4)–96(5).
[38] HESA, Témoignages, 27 avril 2023, 1120 (L’hon. Jean-Yves Duclos, ministre de la Santé).
[39] HESA, Témoignages, 27 avril 2023, 1220 (Mélanie Bourassa Forcier, professeure titulaire, à titre personnel).
[40] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[41] HESA, Témoignages, 2 mai 2023, 1105 (Douglas Clark).
[42] HESA, Témoignages, 2 mai 2023, 1105 (Douglas Clark).
[43] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[44] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II, Lignes directrices de la présidente relatives à la conduite des membres du Conseil [p. 89 du PDF].
[45] HESA, Témoignages, 2 mai 2023, 1105 (Douglas Clark).
[46] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Onglet 7.
[47] HESA, Témoignages, 27 avril 2023, 1240 (Mélanie Bourassa Forcier).
[48] HESA, Témoignages, 27 avril 2023, 1240 (Mélanie Bourassa Forcier).
[49] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages [p. 10 du PDF].
[50] HESA, Témoignages, 2 mai 2023, 1125 (Douglas Clark).
[51] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Annexe C1.
[52] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Annexe C2.
[53] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Annexe B.
[54] HESA, Témoignages, 2 mai 2023, 1110 (Douglas Clark, directeur exécutif, Conseil d’examen du prix des médicaments brevetés); et Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Onglet 5.
[55] HESA, Témoignages, 27 avril 2023, 1100 (L’hon. Jean-Yves Duclos).
[56] HESA, Témoignages, 2 mai 2023, 1115 (Douglas Clark).
[57] HESA, Témoignages, 2 mai 2023, 1145 (Douglas Clark); et Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Onglet 6.
[58] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II [p. 121 du PDF]; et HESA, Témoignages, 2 mai 2023, 1110 (Douglas Clark).
[59] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Annexe B.
[60] Matthew Herder, Re: Letter of Resignation, 20 février 2023 [disponible en anglais seulement].
[61] HESA, Témoignages, 2 mai 2023, 1150 (Matthew Herder, directeur).
[62] HESA, Témoignages, 2 mai 2023, 1135 (Matthew Herder, directeur).
[63] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[64] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[65] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages [p. 18 du PDF]; et Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II [p. 143 du PDF].
[66] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Annexe F; et Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II.
[67] Correspondances soumises par Matthew Herder conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, B1.
[68] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Conclusion; et HESA, Témoignages, 27 avril 2023, 1225 (Mélanie Bourassa Forcier).
[69] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[70] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[71] HESA, Témoignages, 2 mai 2023, 1205 (Douglas Clark); HESA, Témoignages, 2 mai 2023, 1140 (Matthew Herder); et HESA, Témoignages, 27 avril 2023, 1235 (Mélanie Bourassa Forcier).
[72] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Onglet 9.
[73] HESA, Témoignages, 2 mai 2023, 1140 (Douglas Clark).
[74] HESA, Témoignages, 2 mai 2023, 1100 (Matthew Herder).
[75] HESA, Témoignages, 2 mai 2023, 1100 (Matthew Herder).
[76] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Onglet 10; et Correspondances soumises par Matthew Herder conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, D1.
[77] HESA, Témoignages, 27 avril 2023, 1110 (L’hon. Jean-Yves Duclos).
[78] HESA, Témoignages, 2 mai 2023, 1140 (Douglas Clark).
[79] HESA, Témoignages, 27 avril 2023, 1240 (Mélanie Bourassa Forcier).
[80] HESA, Témoignages, 2 mai 2023, 1100 (Matthew Herder).
[81] Mélanie Bourassa Forcier, Les raisons de ma démission du Conseil d’examen du prix des médicaments brevetés, 3 mars 2023.
[82] HESA, Témoignages, 2 mai 2023, 1100 (Matthew Herder).
[83] HESA, Témoignages, 2 mai 2023, 1100 (Matthew Herder).
[84] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[85] HESA, Témoignages, 27 avril 2023, 1210 (Mélanie Bourassa Forcier).
[86] Correspondances soumises par Matthew Herder conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, B3.
[87] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II [p. 78 du PDF].
[88] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II [p. 78 du PDF].
[89] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II [p. 102 du PDF].
[90] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages; et Mélanie Bourassa Forcier, Les raisons de ma démission du Conseil d’examen du prix des médicaments brevetés, 3 mars 2023.
[91] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, III. Clarifications relatives aux témoignages.
[92] HESA, Témoignages, 27 avril 2023, 1210 (Mélanie Bourassa Forcier).
[93] Correspondances soumises par Douglas Clark conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, Partie II [p. 134 du PDF].
[94] HESA, Témoignages, 27 avril 2023, 1100 (L’hon. Jean-Yves Duclos).
[95] HESA, Témoignages, 27 avril 2023, 1140 (L’hon. Jean-Yves Duclos).
[96] HESA, Témoignages, 27 avril 2023, 1235 (Mélanie Bourassa Forcier).
[97] HESA, Témoignages, 27 avril 2023, 1100 (L’hon. Jean-Yves Duclos).
[98] Correspondances soumises par Mélanie Bourassa Forcier conformément à la motion adoptée par le Comité le jeudi 4 mai 2023, annexe B.
[99] HESA, Témoignages, 2 mai 2023, 1205 (Matthew Herder).